恒特基因联合国科大肿瘤医院深度RNA测序揭示:约50%钻石ALK肺癌患者疗效受RNA剪切异质性影响

ALK变异被俗称为“钻石”变异,而EGFR突变俗称为“黄金”突变。这是因为,晚期肺癌患者若其肿瘤含有ALK基因融合,在接受ALK靶向治疗后目前的中位生存期大于7年,而EGFR突变相应的是2至3 年。
晚期患者中位生存期7年也就意味着,一半晚期患者可生存超过7年,而另一半则短于7年。什么原因导致这另一半的“钻石”埋没以致暗淡无光?带着对未知的探索并寻求解决这一未被满足的临床需求,恒特基因开发了国际领先的深度RNA测序(精准淘“钻”技术),联合国科大肿瘤医院开展研究,揭示了RNA剪切异质性可影响ALK患者靶向治疗的疗效。该研究对今后肿瘤融合基因的诊断提出了更高的要求,也为新的治疗策略提供了理论基础,以期望能使此类晚期肿瘤患者的中位生存期达到10年以上,实现“钻芒耀世”,治愈肿瘤。
ALK变异的发生率约占肺癌的5%,但因为肺癌基数大,ALK变异每年夺走的生命多于所有鼻咽癌夺走的生命,也多于所有黑色素瘤夺走的生命,比甲状腺癌夺走的生命的两倍还多,也相当于所有胆管癌夺走的生命(Global cancer statistics 2020: GLOBOCAN)。
恒特基因拥有国际领先的融合基因诊断技术,拥有国际及中国授权的一系列发明专利,可对肺癌中的ALK、ROS1、NTRK1/2/3、RET,胆管癌中的FGFR 1/2/3/4, 多种白血病、骨肉瘤等基因融合进行精准诊断。
携带相同驱动基因的肿瘤可能对相同的靶向治疗药物有不同的反应。靶向治疗的一大缺点是不可避免的耐药。已明确了的ALK靶向治疗耐药机制有激酶结构域突变、扩增和不依赖ALK的信号通路激活。肿瘤异质性作为癌症耐药的基础机制,已在多基因多克隆改变的病例中进行了大量研究,然而,对同一肿瘤中共存的多个转录剪切体(alternative splicing)的分布及其对治疗的影响却是未知的。
据此,恒特基因联合国科大肿瘤医院,推测多个mRNA alternative splicing混合剪接体可能与疗效及耐药有关,并利用深度RNA测序技术,对在克唑替尼治疗前的ALK融合肺癌开展了一项研究。结果显示,多种ALK alternative RNA spicing剪切体混合型广泛存在于ALK融合阳性的肿瘤中,约有半数(47.1%)。含有RNA混合剪切体肿瘤患者的总生存时间明显比单纯剪切体的要短(中位OS分别为18.5个月与49.8个月,P值0.016);治疗后无进展生存期也明显更短(中位PFS分别为8.9个月与15.9个月,P值0.006)。
利用恒特基因的“一管双检”RNA和DNA深度测序方法,研究团队对在克唑替尼治疗后的ALK融合肺癌队列中检测到各种EML4-ALK传统分类的亚型。两个主要亚型是v1(n = 23; 45.1%)和v3(n = 19; 37.3%),频率较低的亚型是v2(n = 5; 9.8%)、v5'(n = 3; 5.9%)和v5(n = 1;2.0%)。按照RNA剪切异构体来分类,在24例(47.1%)肿瘤中检测到多种EML4-ALK RNA混合异构体,在27例(52.9%)肿瘤中检测到单一异构体。大多数v3型肿瘤(19个中的16个,84.2%)同时含有v3a(涉及EML4外显子6)和v3b(涉及EML4外显子6加上一个33个碱基的隐蔽外显子)两种异构体(图1A、B、C)。主要异构体占样本内所有异构体的百分比分布从53.1% 到99.8%不等(图 1D)。混合异构体在v3肿瘤中比在非v3肿瘤中更常见(P < 0.001)。另一方面,8个非v3肿瘤(5 个 v1、2 个 v5’和一个 v2)存在混合异构体,占总共24个混合RNA异构体肿瘤的33.3%。患者基线特征在v3和非v3组之间以及单一和混合异构体组之间是平衡一致的。
图1. EML4-ALK融合变体断点和v3a和v3b (A) 亚型的示意图。使用IGV对三个具有混合RNA剪切异构体的NSCLC病例进行基因组比对的示例可视化(B),使用锚定多重 PCR 以针对任何5'融合伙伴的ALK激酶外显子20(箭头表示 heminested 基因特异性引物)。案例#28包含两个亚型v3a和v3b。v3b是通过剪接经典EML4内含子6中的隐秘外显子形成的。案例#38包含主要的v1剪切体和少数的异构体v1(?)。案例#45包含主要剪切体v1和两个次要异构体 v1(?a) 和 v1(?b)。这两个少数异构体分别是通过剪接经典EML4内含子13中的两个隐秘外显子而形成的(B)。案例的数据分析输出结果示例显示了所有融合读数中主要剪切体的比例(C)。在所有含异构体的24个样品中,主要剪切体的百分比分布,按传统的变异类型(非 v3、v3a 和 v3b)进行区分(D)。
EML4-ALK传统变异分型、RNA剪切构体数和无进展生存(PFS)
研究团队首先比较了融合传统变异分型和剪切构体数与克唑替尼治疗后的无进展生存期(PFS)的关系。v3患者与非v3患者的PFS差异无统计学显著性意义(中位PFS: 8.9 m vs 13.8 m, P = 0.082;图2A)。混合RNA异构体患者的PFS明显短于单一RNA异构体患者(中位PFS: 8.9 m vs 15.9 m, P = 0.006;图2B)。由于传统变异分型与RNA剪切构体数相关,为了控制传统分型可能对RNA剪切构体与PFS关系的影响,反之亦然,我们进一步进行了分层分析。结果显示,在混合RNA异构体组中,v3型和非v3型的PFS无差异(中位PFS: 9.0 m vs 7.6 m;P = 0.928;图2C)。相比之下,在非v3型中,混合RNA异构体患者的PFS短于单一RNA异构体患者的PFS(中位PFS: 7.6 m vs 15.9 m;P = 0.045,图2D)。
图2. Kaplan-Meier曲线比较EML4-ALK非小细胞肺癌患者按融合变异传统类型(v3 与非 v3,A)和异构体数量(单一与混合,B)区分的无进展生存期 (PFS)。进一步分层分析,比较在混合异构体的患者中传统分型的 PFS (C) ,以及在非v3型患者中的单一与混合异构体患者的 PFS (D)。
EML4-ALK传统变异分型、RNA剪切构体数和总生存期(OS)
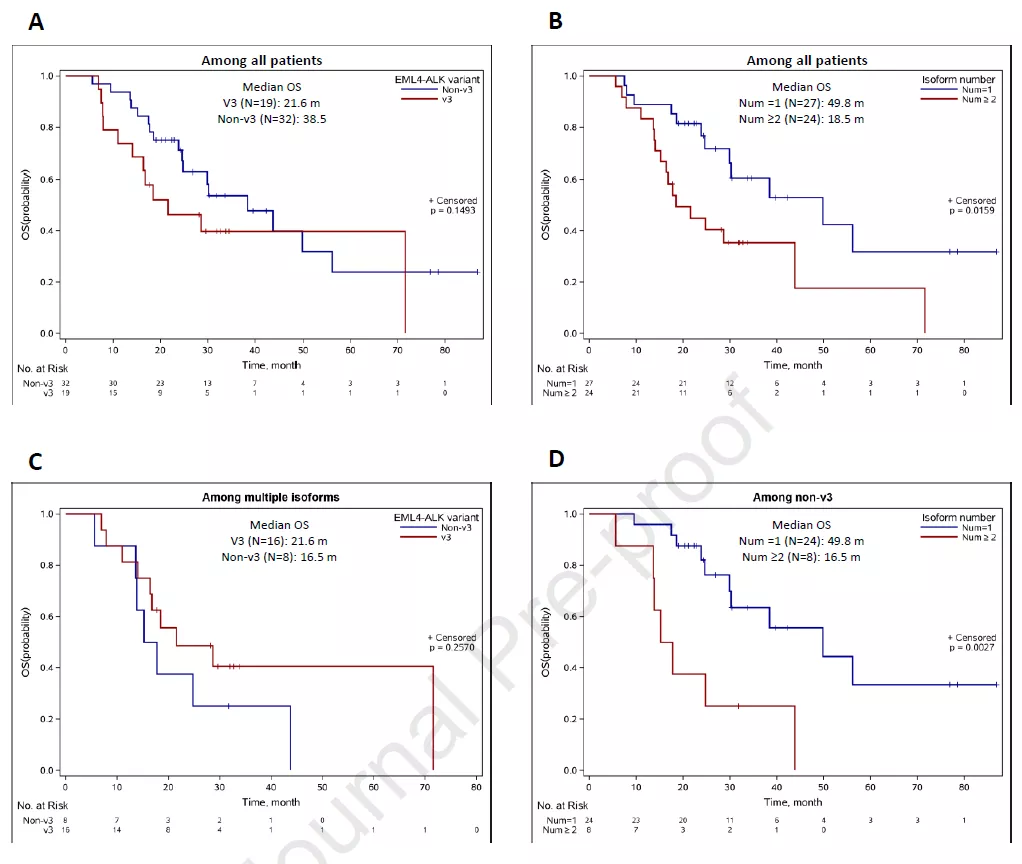
研究观察到,v3患者的总生存期短于非v3患者的,但差异无统计学意义(中位OS: 21.6 m vs 38.5 m, P = 0.149;图3A)。混合RNA异构体肿瘤患者的OS显著短于单一RNA异构体肿瘤患者的OS(中位OS: 18.5 m vs 49.8 m;P = 0.016;图3B)。分层分析结果显示,在混合RNA异构体患者当中,传统变异分型与OS相关性无统计学意义(中位OS v3 vs非v3: 21.6 m vs 16.5 m; P = 0.257; 图3C)。然而,在非v3患者中,混合RNA异构体相比单一RNA异构体具有显著更短的OS(中位OS: 16.5 m vs 49.8 m;P = 0.003; 图3D)。
图3. Kaplan-Meier曲线比较EML4-ALK非小细胞肺癌患者按融合变异传统类型(v3 与非 v3,A)和异构体数量(单一与混合,B)区分的总生存期(OS)。进一步分层分析,比较在混合异构体的患者中传统分型的 OS (C) ,以及在非v3型患者中的单一与混合异构体患者的 OS (D)
三种ALK抑制剂对H2228细胞系抑制作用的体外研究
为了评估ALK TKI对表达v3a和v3b的细胞的抑制功效,研究团队用H2228细胞进行了体外实验。结果表明,具有EML4-ALK v3融合的H2228细胞用三种不同的 TKI,即克唑替尼、色瑞替尼和阿莱替尼处理3周,每周使用XTT测量细胞活力。与未处理的对照相比,三种TKI处理在第1周导致细胞活力降低52-72%,在第2周降低43-76%,在第3周降低 24-69%。有趣的是,在治疗1、2和3周后,与未治疗的对照组相比,在所有三个TKI治疗组中观察到v3a与v3b的比率增加:克唑替尼从1.57增加到1.94 和2.52,色瑞替尼从1.26增加到2.84和2.85和阿莱替尼分别从1.69到1.92和2.48。结果通过使用v3a和v3b特异的Taqman探针RT-qPCR和NGS分别证实。
上述v3a相对于v3b RNA表达富集的观察表明,表达v3a的细胞可能对TKI抑制剂更具抗性。为了研究v3a和v3b变异是否是互相独立的单细胞特征,或者变异是否由于两种同种型的随机表达而共存于同一细胞中,研究人员进行了单细胞 RT-PCR实验。为了实现单细胞目标扩增,在48个孔中对每个反应孔进行了约1个细胞的有限稀释。研究团队选择每孔1个细胞的原因是因为,根据泊松分布,当λ(预期发生率)为1时,每孔获得0、1和≥2个细胞的概率分别为0.3679、0.3679和0.2642,总共48个反应将产生大量带有空(预期18/48)、单个(预期18/48)和多个(预期13/48)扩增子带的反应。结果显示与泊松分布的预期数量一致(Fisher精确检验 P = 0.903),表明达到真正的单细胞扩增,并表明H2228细胞主要包含仅v3a或仅v3b的独立RNA剪切事件。
该研究运用恒特基因PANO-Seq的“一管双检”RNA和DNA深度测序方法,发现有近一半的ALK融合阳性的肺癌具有混合RNA剪切异构体。如此高的比例,可能的原因是PANO-Seq能全面捕获基因组、表观遗传、和RNA剪接多层面异质性的能力,以及基于单端开放(仅锚定在ALK一端)的技术优势的结果。此外,PANO-Seq具有高富集效率(PCR vs杂交捕获)和使用近外显子与内含子边界的PCR引物,即使在FFPE组织中的mRNA被高度降解时也具有高检测灵敏度(同批样本PANO-Seq 94%质检通过率vs其它RNA-seq方法37%的通过率【中国医科院肿瘤医院2021年发表的研究结果】)。此外,恒特基因的生物信息学解决方案可以全面绘制隐性外显子剪接图,这也有助于在研究患者中捕捉到高频率的融合异质性。
ALK的不同基因融合伙伴可能会影响融合蛋白在细胞内的位置,因此可能具有不同的功能和相关的临床结果。不断演变的点突变所致的耐药机制已经充分研究证明,而关于混合RNA剪切异构体可能导致的临床疗效不佳的分子机制是未知的。研究团队推测,in-frame的插入和缺失变异(剪切异构体)可能导致比点突变来得更显著的蛋白质结构特性的变化。因此,含有的混合RNA剪切异构体的肿瘤可能表达结构差别较大的ALK蛋白,导致其比单一结构蛋白(单一RNA剪切体)更容易产生对靶向药的抗性。
含有混合RNA剪切异构体的ALK融合阳性肺癌患者在接受克唑替尼治疗后的疗效差,这一结果是否可以扩展到第二、三、更新一代的ALK靶向治疗药仍有待评估。含有混合RNA剪切异构体的ALK融合肺癌患者可考虑在一线使用强效的抑制剂。同时,未来可结合针对RNA的剪切功能通路,考虑制订相应的治疗策略。
本文由 SEQ.CN 作者:白云 发表,转载请注明来源!