
-引言-
就像我们讨论早上醒来的第一件事时,往往会忽略“睁开眼睛”一样,当我们讨论基因检测领域新兴技术液体活检的潜力与边界时,往往也会忽略真正的第一步——采血。尽管常常被很多人忽略,但事实上,采血的质量却是其后所有检测流程的基础。而真空采血管,作为高效的采血工具,发展至今已有80多年,为所有光鲜的新技术铸就了坚实的基石。今天,就让我们将液体活检和真空采血管放到同一时间线上,重新认识真空采血管这位老朋友。
液体活检的历史一般可追溯到1869年:澳大利亚医生Thomas Ashworth在刚去世的肿瘤患者血液中发现和肿瘤细胞相似的细胞(如图1所示)1,猜测肿瘤细胞会随血液循环移动,这可能解释了为什么该患者身上有多处肿瘤转移。这也是肿瘤循环细胞(CTCs)的概念首次被提出2。而此时,真空采血管尚未问世。

图1. Thomas Ashworth 1869年发表在澳大利医学期刊上的描述肿瘤循环细胞的文章。
在真空采血管出现之前,医生们都是使用注射器进行采血。注射器针筒最早可追溯到公元9世纪的埃及,当时外科医生Ammar ibn 'Ali al-Mawsili发明了注射器针筒用于取出病人眼中的白内障。1844年,爱尔兰医生弗朗西斯·林德发明了空心针,并用它进行了第一次有记录的皮下注射。而真空采血管据记载发明于1937年,1949年Joseph Kleiner将第一个真空采血管专利授权给BD公司3,图2为专利中真空采血管的专利设计图,已经很接近现在临床使用的真空采血管了。

图2. 第一个真空采血管专利。
值得关注的是,在第一个真空采血管专利被审核期间,法国的Mandel和Metais(1948年)发现血液中有游离的核酸4,于是游离DNA(cell-free DNA,cfDNA)和游离RNA(cell-free RNA,cfRNA)的概念也首次被提出5。在1958年关于分离CTCs方法文章中可以看到(图3),当时真空采血管还未普及,注射器采血还是普遍的采血方法6。

图3. 分离CTCs方法中同时从锁骨下静脉(导管)和肘前静脉(注射器)采集血样。
到了1950年代,液体活检中常用的EDTA抗凝管就已经被发明出来3。科学家随后还于1960年代发明了肝素抗凝管。但其后陆续发表的液体活检相关工作所用采血管都不大一样,主要的差异是使用普通采血管还是抗凝采血管,分别对应从血清(serum)和血浆(plasma)中提取cfDNA。
1977年科学家首次证实癌症患者的血液中cfDNA中存在循环肿瘤DNA(ctDNA)时7,使用的是普通的采血管,又叫血清管。由于玻璃管壁的二氧化硅可以诱导血液凝结,血液常温自然凝结1小时后,科学家需要从上清(血清)中提取cfDNA。
1994年,瑞士科学家通过cfDNA分析鉴定RAS点突变8。此时使用的是肝素抗凝管,离心后从上清(血浆)中提取cfDNA。
1996年,Nature Medicine背靠背发表两篇文章,来自美国和瑞士的科学家分别在血清和血浆中发现肿瘤患者微卫星突变,分别使用了普通采血管(血清)9和肝素抗凝管(血浆)10。
因此,1997年卢煜明检测怀孕妇女血液中胎儿的cfDNA时,分别用EDTA管和普通管采血,结果在血浆和血清都检出了胎儿的cfDNA(约占总cfDNA的5%),不过血浆检出率稍高11。
其后陆续几篇方法学文章,逐步确立了使用EDTA管取血,离心,从血浆中提取cfDNA的标准流程12-14。EDTA可以螯合Ca2+起到抗凝作用,防止凝结过程中白细胞裂解释放出DNA;还可以结合其他二价金属离子,抑制各种金属依赖酶的活性,其中包括抑制核酸酶,减少cfDNA降解;另外,EDTA不会像肝素一样干扰PCR的扩增。不管用什么管采血,都需要及时(< 6 小时)分离血浆(血清),否则血液中的有核细胞会死亡裂解释放DNA污染cfDNA。这要求血液在采血点即时处理,无法远距离运输到检测中心集中处理,这对液体活检的应用造成了极大的限制。

图4. 甲醇把蛋白和核酸交联在一起15。
为了解决以上局限,我们需要稳定血液中的有核细胞(主要是白细胞),防止它裂解释放DNA。传统的细胞稳定剂(固定剂)如甲醛,它可以作为交联剂和氨基反应,形成蛋白-蛋白、蛋白-核酸、核酸-核酸交联,稳定细胞,减少血细胞裂解。但是核酸上的交联会影响cfDNA的提取和扩增(见图4)。
为此,自2010年起,Streck、PAXgene、Roche和Lakebio相继推出了无甲醛的cfDNA专用采血管,可以避免细胞来源基因组DNA污染,防止样品中cfDNA降解,同时防止cfDNA发生与其它生物大分子(如蛋白)交联16。值得关注的是,Lakebio为一家成立于2018年的国内公司。从图5可以看出,相对于EDTA管常温保存7天就出现细胞明显破裂,Lakebio和Streck的cfDNA采血管常温保存14天仍然能够维持细胞形态完整。将孕妇外周血分别收集于Lakebio和Streck采血管,常温运输4天后进行血浆分离,两种采血管检测到的胎儿cfDNA百分比接近,见图6。说明Lakebio采血管和Streck采血管都可以长时间保持血液中的胎儿cfDNA稳定不变。

图5. 同一志愿者的EDTA采血管、Lakebio采血管和Streck采血管外周血样本置于常温(20-30℃)保存,于0、3、7、14天取少量样本进行涂片,瑞姬氏染色后镜下观察。
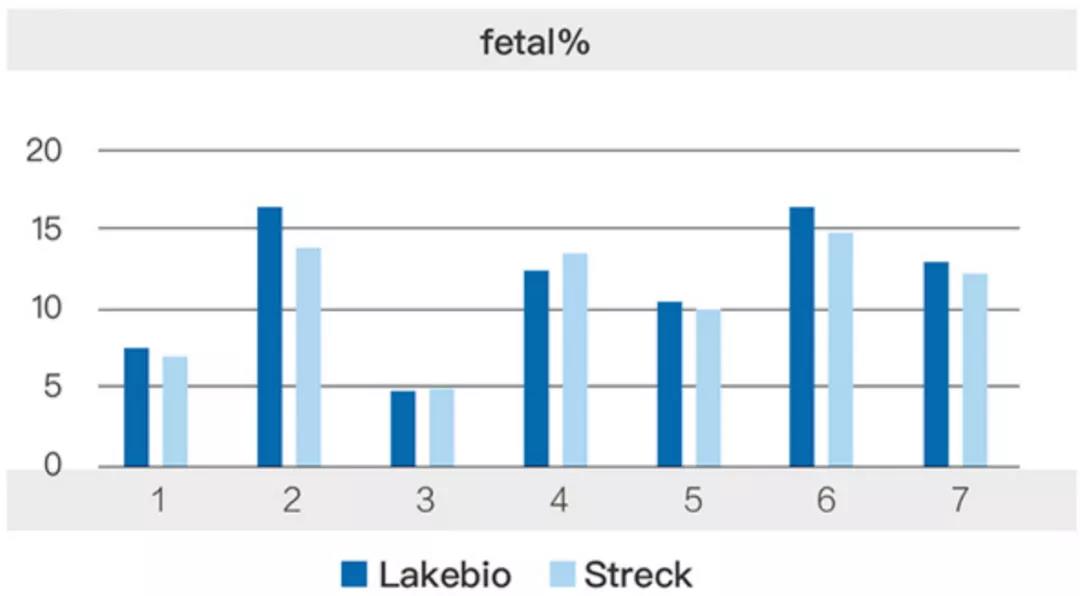
图6. Lakebio采血管与Streck采血管fetal%结果相近(n=7)。
自2011年临床批准的NIPT技术开始,基于cfDNA的液体活检技术蓬勃发展。目前,Lakebio cfDNA采血管已经投入市场使用,并与贝瑞基因等国内领先的基因检测企业全面合作,其品质获得了临床验证。
除了cfDNA外,研究人员还可以利用血液中的cfRNA、外泌体、TEP等成分进行液体活检。然而,不管是EDTA采血管还是cfDNA采血管,都不能使这些成分稳定存在。经过研究发现,cfDNA采血管虽然稳定了白细胞,但是血液中的红细胞和血小板裂解时会释放外泌体和凋亡小体等胞外囊泡(Extracellular Vesicles),这些囊泡的进一步裂解会释放出更多cfRNA,使血液中的cfRNA不断增加,影响检测结果。
基于以上发现,Lakebio和Streck相继推出了cfRNA采血管,通过添加代谢抑制剂,如叠氮化钠、氟化钠、甘油醛等,抑制细胞代谢,抑制线粒体呼吸链,阻断细胞凋亡和坏死途径,维持血液中cfRNA含量的稳定。如图7所示,Lakebio和Streck的cfRNA采血管室温保存7天,cfRNA中的c-fos基因拷贝数十分稳定,而EDTA管中的c-fos基因拷贝数已经显著增加。

图7. 液滴数字PCR检测不同采血管第0天、3天和7天的c-fos基因在cfRNA中的拷贝数变化。
回顾历史,我们可以发现,采血管的出现便利了液体活检技术的研究和临床应用,液体活检技术反过来又催生了新的采血管的发明,两者相辅相成,共同进化,一起为广大患者谋福利。
扫描下方二维码,即可申请Lakebio游离DNA常温保存管免费试用资格。数量有限,先到先得哦!

参考文献:
本文由 SEQ.CN 作者:戴胜 发表,转载请注明来源!