
基于组织检测的肿瘤突变负荷(tissue-based Tumor Mutational Burden, tTMB)是预测免疫检查点抑制剂(anti-PD-1/PD-L1)疗效的潜在生物标记物。近期,两项基于血液检测肿瘤突变负荷(blood-based Tumor Mutational Burden, bTMB)的研究亦得到了相似的结果,即bTMB能预测非小细胞肺癌(NSCLC)患者免疫治疗无进展生存期(PFS)的获益。但与tTMB不尽相同的是,在上述两项研究中,bTMB均未能预测免疫治疗总生存期的获益。考虑到总生存期是评估肿瘤临床获益的“金标准”,显著延长远期生存是免疫治疗的一大亮点与优势,故探寻bTMB与tTMB不同预测效能的潜在生物学机制,并进一步优化bTMB从而指导临床实践具有重要意义。
当地时间12月12日,由中国医学科学院肿瘤医院王洁教授团队与思路迪合作完成的最新bTMB学术成果在线发表于Journal of Thoracic Oncology期刊 (IF = 12.5),论文题为:“Allele frequency-adjusted blood-based tumor mutational burden as a predictor of overall survival for non-small cell lung cancer patients treated with PD-1/PD-L1 inhibitors”。
该研究的核心创新点在于将患者的ctDNA含量(研究中以maximum somatic allele frequency-MSAF表示)纳入bTMB的算法模型中,首次提出了LAF-bTMB(low allele frequency-bTMB)的概念,并基于这一概念开发了新型算法。在此基础上,研究团队通过多个国内外临床队列验证了LAF-bTMB算法的预测效能,证明其确实优于当前国际主流算法;与此同时,研究结果还表明了LAF-bTMB-H与OS、PFS和ORR存在显著相关性,证明LAF-bTMB能有效预测患者的总生存获益。
首先,研究团队通过NCC队列、POPLAR及OAK三个队列,分析bTMB预测OS的效能;随后,在POPLAR和OAK两个队列中,进行bTMB算法的优化,提出LAF-bTMB的概念;最后在NCC队列中,验证LAF-bTMB和免疫治疗疗效的关系。

图1. 研究流程图。图片来源:Journal of Thoracic Oncology
研究团队对已发表的两篇bTMB文章的数据(Nature Med, 2018; JAMA Oncol, 2019)进行分析后发现,不管是NCC队列,抑或POPLAR&OAK队列,bTMB均无法区分免疫治疗OS获益人群。研究团队推测,这可能由于bTMB的检出需要依赖于血液中ctDNA的含量,如果ctDNA含量越高,bTMB的检出也越高。但是ctDNA含量越高,患者的肿瘤负荷相应也越高,预后更差,所以导致无法预测免疫治疗的长期OS获益。
后续结果验证了这一假设,研究团队在这三个队列中均观察到bTMB和ctDNA含量(MSAF代表)的正相关关系,同样,在bTMB高的人群中,ctDNA含量亦高,而ctDNA含量越高的患者,不管是免疫治疗或化疗,患者的总生存反而更差。这就形成了一个悖论:bTMB-H的患者理论上可能对免疫治疗更敏感,但同时因其ctDNA含量更高,故而预后更差,这一因素可能导致bTMB无法准确预测免疫治疗的疗效。这些结果提示,如果需要对免疫治疗疗效进行预测,计算bTMB时需要根据ctDNA的含量进行校正。

图2.在NCC和POPLAR及OKA两个队列中,bTMB均无法区分免疫治疗OS获益人群。图片来源:Journal of Thoracic Oncology
研究团队进一步发现bTMB的高低确实与ctDNA的含量有着正相关关系,但是这种正相关关系通常发生在丰度较高的突变中。基于此,研究团队将bTMB分成两个部分,一部分是由低丰度的突变组成(low-allele frequency bTMB, LAF-bTMB),另一部分是由高丰度突变组成(high-allele frequency bTMB, HAF-bTMB)。结果显示,低丰度的突变数量并不随着ctDNA的含量而发生变化,而高丰度的突变数量会随着ctDNA的含量而变化,而这一差异在突变丰度的阈值为5%时最为明显。
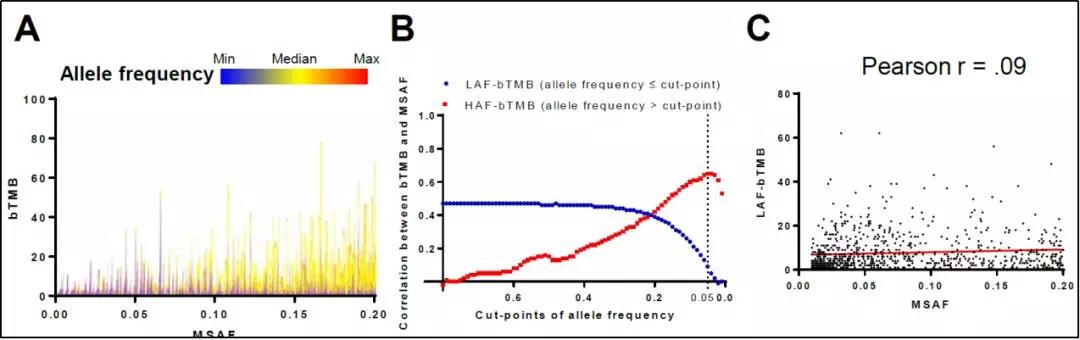
图3. bTMB和ctDNA含量(MSAF代表)有正相关关系,且正相关关系通常发生在丰度较高的突变中。图片来源:Journal of Thoracic Oncology
基于以上发现,研究团队将突变丰度≤5%的突变数量定义为LAF-bTMB,而>5%的突变数量定义为HAF-bTMB(计算的方法如下图所示)。

图4. 计算LAF-bTMB的模拟示意图。图片来源:Journal of Thoracic Oncology
随后,研究团队在POPLAR及OAK队列中发现,HAF-bTMB越高,患者的预后越差,这提示LAF-bTMB可能作为免疫治疗的biomarker。研究团队紧接着利用POPLAR和OAK队列进行了LAF-bTMB cutoff值的确定及验证。在POPLAR队列中,当LAF-bTMB≥12时,免疫治疗组的OS显著优于化疗组,而LAF-bTMB<12时,免疫治疗组的OS与化疗组无差异(P interaction = 0.04);同样的结果也在OAK队列中得到了验证。

图5. 在POPLAR和OAK队列中,LAF-bTMB可以预测患者免疫治疗OS获益。图片来源:Journal of Thoracic Oncology
基于POPLAR及OAK研究的设计及生存数据的高度一致性,研究团队将两项研究进行了合并以分析LAF-bTMB的可靠性。结果显示,LAF-bTMB能很好地预测免疫治疗的OS(P interaction = 0.006)及PFS(P interaction<0.001)。

图6. POPLAR及OAK研究合并分析的结果显示LAF-bTMB能预测免疫治疗的PFS和OS获益。图片来源:Journal of Thoracic Oncology
研究团队进一步比较了LAF-bTMB与传统bTMB在预测疗效上的差别。两个研究合并共有106名患者用此两种不同的bTMB预测疗效。研究团队发现,在传统bTMB低、但LAF-bTMB高的患者人群中,接受免疫治疗的OS要优于化疗;但在传统bTMB高、LAF-bTMB低的人群中,接受免疫治疗的OS和化疗无差异。这样的结果提示,LAF-bTMB能够比传统的bTMB更准确地识别免疫治疗获益的人群。

图7. LAF-bTMB比传统的bTMB更能识别免疫治疗获益的人群。图片来源:Journal of Thoracic Oncology
最后,研究团队利用中国NCC队列(n=64)进一步验证了LAF-bTMB对免疫治疗OS的预测意义。虽然NCC队列和POPLAR&OAK队列中所使用的免疫药物和panel存在不同,但是在NCC队列中,研究团队观察到了同样的现象,即LAF-bTMB的数量检出不依赖于ctDNA的含量,在LAF-bTMB的cut-off值为7时,LAF-bTMB高的患者免疫治疗的OS,PFS,ORR均优于LAF-bTMB低的患者。

图8. 中国NCC队列(n=64)进一步验证了LAF-bTMB对免疫治疗OS的预测意义。图片来源:Journal of Thoracic Oncology
本项研究首次揭示了影响bTMB预测效能的潜在因素——ctDNA含量,并通过重新定义的LAF-bTMB解决了上述问题。POPLAR、OAK及中国人群的独立验证队列均显示LAF-bTMB能有效预测免疫治疗的OS及PFS。本项研究为探寻bTMB预测效能的潜在生物学机制指明了方向,对进一步优化bTMB从而指导临床实践具有重要意义。
中国医学科学院肿瘤医院王洁教授为该研究论文的通讯作者,王志杰教授、段建春教授以及思路迪公司王国强博士为论文共同第一作者。
本文由 SEQ.CN 作者:陈初夏 发表,转载请注明来源!