
自2006年在全世界第一个实现单细胞全基因组测序,华人科学家张鹍教授在单细胞测序领域的研究一直处于全球领先地位。2018年11月,张鹍教授团队因在单细胞研究领域的杰出贡献,荣获美国国立卫生研究院(NIH)两项共计1400万美元的研究基金,用于构建单细胞水平的人体器官3D图谱,推动精准医学进入单细胞时代。在这期间,张鹍教授成为美国加州大学圣地亚哥分校生物工程系终身教授、系主任;在专业领域,他首创高通量甲基化无创检测技术,领导完成了“美国脑基因组测序计划”,利用单细胞核测序绘制了成年人脑第二代单细胞图谱。
如今,人体器官3D图谱再添肾脏单细胞图谱这一重要模块。美国加州大学圣地亚哥分校张鹍教授团队和华盛顿大学医学院Sanjay Jain教授团队合作,对来自不同个体肾脏组织的17000多个肾脏细胞进行了单细胞核RNA测序,发现了慢性肾病、糖尿病和高血压相关性基因在肾脏细胞中的特异性表达,进而绘制了成人肾脏单细胞图谱,可适用于临床,并有望指导相关疾病的靶向治疗。研究结果于当地时间2019年6月27日发表在国际顶级期刊《自然·通讯》(Nature Communications)上。今天,测序中国与各位读者一道来剖析一下这项研究的方法和重要意义。

图1:《自然·通讯》官网截图
首先,肾脏具有重要的生理功能。肾脏可生成尿液,排泄废物,同时重吸收有用物质,具备调节水、电解质、酸碱平衡,生成红细胞以及调节血压等复杂的功能。
其次,肾脏中不同管状结构上皮细胞的特异性功能,令研究者们着迷。人类的肾脏由超过100万个肾单位、40多种不同类型的细胞组成。尿液从肾小球过滤开始,通过肾单位的不同部位汇集到集合管,再进入输尿管和膀胱,这个过程中的各个肾脏结构有广泛的管状组成部分,且都分布着连续的上皮内衬。在尿液的形成过程中,这些上皮细胞因区域不同而具有复杂的特异性作用,并可与肾间质、血管网、淋巴管、驻留免疫细胞、细胞外基质、神经等相互作用。
除此之外,肾脏疾病与肾脏中不同部位的上皮细胞的特异性功能有关。上皮细胞的功能异常会导致糖尿病、高血压、慢性肾病(CKD)和终末期肾病(ESRD)等在内的严重的健康问题,影响人们的生活质量,给社会带来沉重的医疗负担。因此,绘制肾脏分子图谱,可帮助人们从生理和病理的角度充分理解正常和异常肾功能的细胞组成及其相关功能属性,可为重建成人肾组织和个性化医疗提供新的靶标。
这项研究的样本来自16位部分或全部肾切除术的活体患者以及已故的肾脏捐赠者。为了绘制这份成人肾脏细胞图谱,来自UCSD和华盛顿大学的2个团队在肾脏精准医学项目(KPMP)联盟的资助下开发了一套能高效稳定处理成人组织样本的单细胞测序流程,利用这个方法进行了27个试验,分析了17659个肾脏细胞,并进行了单细胞核RNA测序,以了解每个细胞的基因表达情况。

图2:肾脏组织处理流程
研究者们运用PAGODA2进行单细胞测序分析,标记已知基因与富集簇基因,并与已发表的基因数据进行对比,区分已知和新发现的肾脏基因表达图谱,根据RNA转化的蛋白质不同,生成相关热图。最终,研究者们发现了30个不同的细胞群,分别代表在肾脏中发现的常见和罕见的细胞类型,并且这些细胞类型具有跨皮质和髓质的空间分布。

图3:肾脏组织处理方法及QC处理后的单核细胞UMAP可视化图谱
通过这种方式,研究者们确定了肾小球上皮、内皮和间质的主要细胞分类。值得关注的是,研究者们在这项研究中不光描绘了与现有研究一致的细胞类型,还发现了之前在皮质与髓质之间未识别的罕见细胞类型。
研究者们认为,与大规模的人体研究相比,这项研究的snDrop-seq方法能让肾细胞类型和亚型有更高的分辨率,并且减少人体组织样本处理过程中引起的人工假象,可以更准确地代表肾脏组织学组成的细胞群。简而言之,丰富的数据让人类肾脏分子图谱更加清晰,可以更容易理解肾脏在疾病发展中所呈现的变化。
1. 发现肾脏中与慢性肾炎和高血压相关的基因和细胞群
肾脏的不同区域和细胞类型在调节血压中发挥着关键的作用,不同部位出现功能障碍可能是CKD和高血压的重要原因。例如,亨利氏袢(LOH)、远曲小管(DCT)和集合管(CD)等肾脏部位是现有抗高血压治疗的靶位,对应的降压药物分别为袢利尿剂、噻嗪类利尿剂、保钾利尿剂,而肾素-血管紧张素-醛固酮系统(RAAS)抑制剂则是通过调节肾小管特定区域的蛋白质表达来调节血压和体液平衡,起到保护心血管和肾脏的作用。
基于此,研究者们利用100多万人的全基因组数据来识别与CKD和高血压等疾病关联的的易感基因,探索肾脏中各种细胞类型与这些疾病的特异关联。在100多万人的全基因组数据中,有674个基因与CKD的发生风险有关,有220个与高血压的发生风险有关。在本研究中,研究者们找到了111个CKD风险相关基因和56个高血压风险基因在肾脏特定细胞类型有特异性表达。通过这些基因,这些慢性病的风险因子可以精确定位到某个类别的肾脏细胞。其中,在肾小囊脏层细胞群(又称足细胞,POD)有CKD风险基因的高富集,而肾小球系膜细胞群(MC)则表现为高血压风险基因的高富集,如图4所示。

图4:与慢性肾炎(CKD)和高血压发生风险相关基因在细胞群上的特异性表达
2. 近端小管细胞群(PT-1-5)中发现新的肾细胞类型,与疾病的发生和预后相关
研究者们在近端小管(PT)的直部(S2)和细部(S3)发现了不同的细胞群,即Unk(29)和PT-4(6),如图5所示。
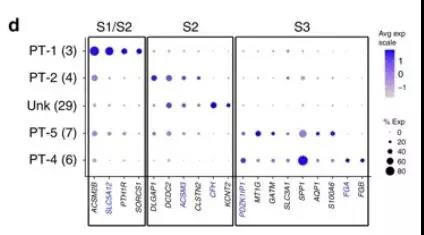
图5:将PT簇Unk和PT-4定位到S2和S3区段。注:近端小管的3个区段:S1-曲部(近曲小管)、S2-直部、S3-细部
Unk细胞群(29)特异表达补体因子H基因(CFH)。CFH基因可参与编码与抵御侵袭性病原体,是先天免疫系统的一个组成部分。医学遗传学文献已经报道了CFH基因突变与包括非典型溶血性尿毒综合征(AHU)、C3-肾小球病(C3G)和终末期肾脏疾病(ESKD)等在内的肾脏疾病有关。根据Unk细胞群的特定分布,我们可以把这三种病的病理损伤机制精确定位到肾脏近端小管中部的这类上皮细胞。
同样地,PT-4(6)显示了LRP2的不同表达,具有与S3区段相关的表达特征,而且体现了独特表达的纤维蛋白原α(FGA)和β链(FGB)基因(见图4)。FGA/FGB基因编码纤维蛋白原,可在肾损伤后的炎症和再生中发挥重要作用。但是,如果纤维蛋白原过量,会阻碍肾脏恢复。既往研究表明,尿纤维蛋白原水平升高与CKD进展为ESKD有关。近端小管细部(S3段)容易发生急性肾损伤(AKI),因此,FGA / FGB也可能与AKI进展为CKD有关。
总之,这项研究验证了在PT细胞群中发现的Unk和PT-4新细胞类型,因具有确定的基因表达谱,可能与急慢性肾损伤有关。
3. 其他重要发现
该研究还发现,可参与编码机械感拉伸门控离子通道的PIEZO2基因,在肾小球系膜细胞群(MC)中有特异性表达,表明PIEZO2可能与血流或压力变化时造成的机械性扩张有关,而最近PIEZO2已被确定为有高血压风险的新基因位点。
研究者们进一步研究了不同细胞类型中受体-配体信号机制。最终发现,整联蛋白在不同的细胞类型中表达呈多样性。因此,我们可以根据不同的整联蛋白表达谱,了解不同肾细胞类型和环境的相互作用以及这些表现与疾病的关系。

图6:整联蛋白在肾脏中的多样性表达
总的来说,这项重磅研究对肾脏内的几个主要细胞类型进行了高度详细的分子特征分析,提供了研究肾脏生理和病理的有力依据,有望指导肾脏疾病的分子诊断和靶向治疗。
参考文献:
Lake BB, Chen S, Hoshi M, et al. A single-nucleus RNA-sequencing pipeline to decipher the molecular anatomy and pathophysiology of human kidneys. Nat Commun. 2019;10(1):2832. Published 2019 Jun 27. doi:10.1038/s41467-019-10861-2
本文由 SEQ.CN 作者:白云 发表,转载请注明来源!