
两周来,我们已经在之前三篇文章中,分别盘点了FDA批准的肿瘤靶向免疫治疗药物、CNDA批准的肿瘤靶向免疫治疗药物、FDA批准的伴随诊断产品,作为本系列的最后一篇,让我们来盘点一下CNDA在肿瘤基因检测方面批准的那些体外诊断产品(查看文章:FDA肿瘤靶向免疫治疗药物丨CNDA肿瘤靶向免疫治疗药物丨FDA伴随诊断产品)。
体外诊断(In Vitro Diagnosis,IVD)是指在人体之外通过对人体的血液等组织及分泌物进行检测获取临床诊断信息的产品和服务,其中包含多种细分方向,肿瘤分子基因检测是近些年兴起并日渐活跃的应用领域之一。在IVD注册管理方面,中国国家医疗器械审核机构已经建立较为完善的管理机制及法规文件。目前中国肿瘤相关的基因变异检测也仍是使用IVD的注册审批管理方法,截止到目前为止国家药品监督管理局(China National Drug Administration,CNDA)已经批准了138项国产肿瘤基因检测IVD产品、以及19项进口肿瘤基因检测IVD产品。

图1. CNDA批准的国产肿瘤基因检测IVD技术平台
获得国内批准的国产肿瘤基因IVD检测产品中,以PCR的技术方法占到明显优势地位,目前已有87项之多,占到所有同类产品的60%以上;其次为FISH技术方法(29项),其他技术平台如ARMS、Sanger等方法也有相应产品获批。值得关注的是,近日国内首次批准了一项以NGS为技术平台的检测产品,体现了中国监管机构对NGS技术在临床肿瘤基因诊断应用上的认可。

图2. CNDA批准的国产肿瘤基因检测IVD公司分布情况
获批IVD产品有明显的公司集中特征,以艾德、金菩嘉、雅康博、鑫诺美迪、友芝这五家公司获批产品最多,所拥有的产品数量占到全部同类产品的一半左右,尤其以前两家企业获批产品数量明显领先于其他诸家公司,可见行业中的集中程度。燃石医学则是目前国内首家获批拥有肿瘤基因NGS检测产品的公司。
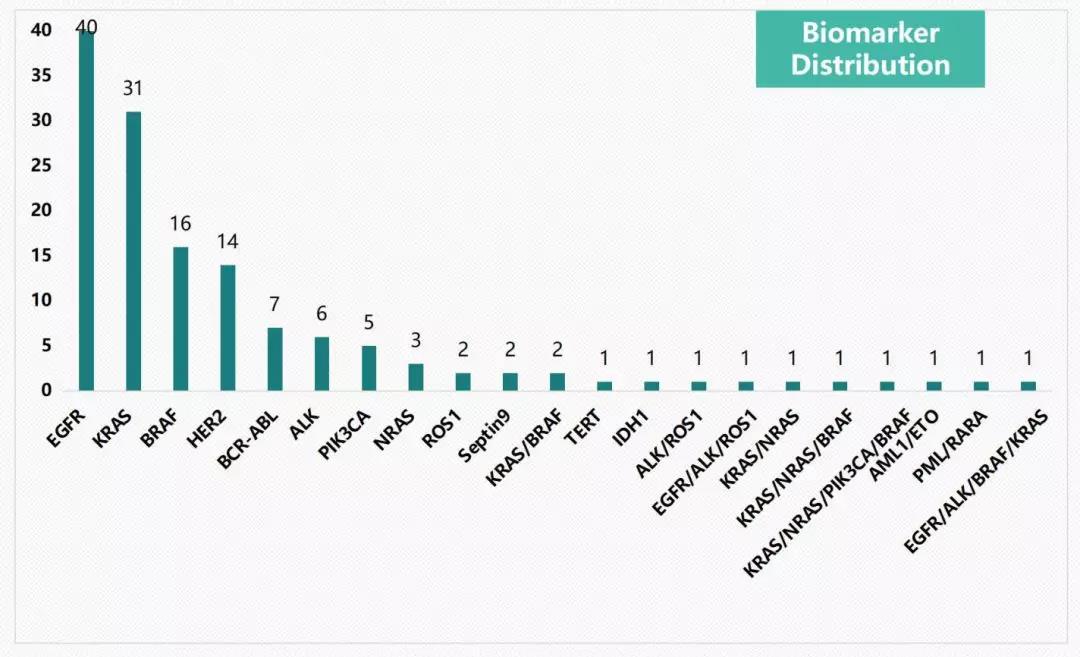
图3. CNDA批准的国产肿瘤基因检测IVD产品Biomarker分布情况
在获批的靶点方面,EGFR基因是其中获批IVD产品最多的biomarker,其次为KRAS、BRAF、HER2、BCR-ABL、ALK等位点。这些biomarker在评估肿瘤靶向药物获益中起到重要作用,靶点获批的数目也一定程度上反应了临床检测上的热度;从目前国内获批产品中我们也可以看出,检测产品仍以单个基因检测为主,另有11个产品获批两个以上biomarker的检测。目前获批的多靶点检测biomarker主要包括EGFR、ALK、ROS1这样肺癌用药常见基因组合,以及KRAS、NRAS、BRAF这样结直肠癌用药常见基因组合。多靶点检测与现今的肿瘤诊疗模式、靶向治疗药物选择密切相关,多基因甚至肿瘤全景基因检测也将会是未来肿瘤药物基因检测势不可挡的发展趋势。

图4. CNDA批准的进口肿瘤基因检测IVD在技术平台及Biomarker上的分布情况
在中国获得批准的进口肿瘤基因IVD检测产品中,以FISH、IHC技术为主要的技术平台,分别是有8项和7项产品;获批靶点则以HER2最多,其次分别为EGFR、ALK、BRAF、KRAS基因。进口获批的这些IVD产品很多在国外已经是相应药物的伴随诊断,与相应靶向药物的药效关系密切相关。
值得一提的是,由于诊断和药物的密切关系,国内对肿瘤基因检测IVD的审批正在朝着伴随诊断CDx的方向努力。目前“人类EGFR基因突变检测试剂盒(多重荧光PCR法)”这一产品是我国首个批准的伴随诊断产品,其中EGFR基因19外显子缺失、L858R突变用于埃克替尼的伴随诊断检测,EGFR基因T790M突变用于奥希替尼的伴随诊断检测,这也是国内第一个基于液体活检的肿瘤基因检测产品。新近批准的首个NGS检测试剂盒“人EGFR/ALK/BRAF/KRAS基因突变联合检测试剂盒(可逆末端终止测序法)”也参照伴随诊断标准,其中EGFR基因中:19号外显子缺失、L858R点突变用于吉非替尼片、埃克替尼的伴随诊断检测,T790M点突变用于奥希替尼的伴随诊断检测;ALK基因中:ALK重排用于克唑替尼的伴随诊断检测。这两项伴随诊断都是集中在非小细胞肺癌的靶向药物选择上的应用,前者是一个基因伴随两种药物,后者则是两个基因伴随四种药物,另外两个基因未达到伴随诊断等级。由于这两项诊断与药物的密切关系,将在临床中为患者提供更为可靠的个体化用药方案参考。相信随着后续法规的不断完善,将会有越来越多按照伴随诊断标准批准基因检测产品。
肿瘤基因检测是靶向免疫治疗中必不可少的一环,目前多种技术平台同台竞技,NGS检测以全新的诊疗模式在其中异军突起。中国监管部门认可并批准第一个肿瘤领域NGS检测产品,在国内行业中是一个里程碑事件。燃石医学有幸取得这一殊荣,诺禾致源、世和基因的NGS试剂盒也将有可能在近期获批,其他各家也纷纷跃跃欲试,行业竞争也将在产品上市后激烈展开。
肿瘤基因检测源自肿瘤临床用药需求,虽然目前国内获批肿瘤靶向免疫药物远少于国外,但国内无论老牌药企,还是新兴药企纷纷开始创肿瘤新药物研发,各家研发管线中的药物不可谓不丰富,随之而来的也将是药物在Biomarker上的检测需求,而这需要肿瘤药物企业和肿瘤基因检测公司的密切配合。近些年,国内监管机构的一些列改革措施,如加入ICH、接受境外数据等,对整个医药行业都是重大利好,在肿瘤基因检测领域,CDx注册法规制度相信也会进一步完善,推动药物与检测的密切关系。医药行业整体呈现一片欣欣向荣的景象,各家群雄逐鹿,在充分的市场竞争和严格的政府监管下,相信会有更多更好的肿瘤药物和诊断应用到临床患者中,使广大中国的肿瘤患者从中获益。到那时,我们再来细数风流人物,当说我们不愧于这个时代!

参考文献:
1. CNDA医疗器械数据库:http://app1.sfda.gov.cn/datasearch/face3/base.jsp?tableId=26&tableName=TABLE26&title=%B9%FA%B2%FA%C6%F7%D0%B5&bcId=118103058617027083838706701567
本文由来源 微信,由 白云 整理编辑!